病毒是一类微小而具有传染性的病原体,正是这种微小的基因组使得病毒circRNA长期以来鲜为人知。近年来,高通量测序技术和生物信息学工具的发展,使得研究人员能够更全面地识别和分析circRNA。然而,目前病毒环状RNA研究比较零散,且只揭示了少数的病毒环状RNA分子。
在之前的工作中565net必赢官方网彭友松团队建立了首个病毒circRNA数据库VirusCircBase(http://www.computationalbiology.cn/ViruscircBase/home.html),该数据库近三年来已经被来自全球60个主要国家和地区的用户使用。为了更加系统地研究病毒circRNA,565net必赢官方网彭友松团队将数据库重建为VirusCircBase 2.0(http://computationalbiology.cn/VirusCircBase2/#/home)并进行一系列探索。
在数据方面,VirucCircBase 2.0中病毒circRNA的数量从46440个增加到60859个。具体来说,病毒种、宿主、组织或细胞类型、样本量、病毒circRNAs与宿主miRNAs之间相互作用的数量分别从23、9、46、337、30818增加到43、22、83、566、72157。此外,新增了1902个全长病毒circRNA(表1)。
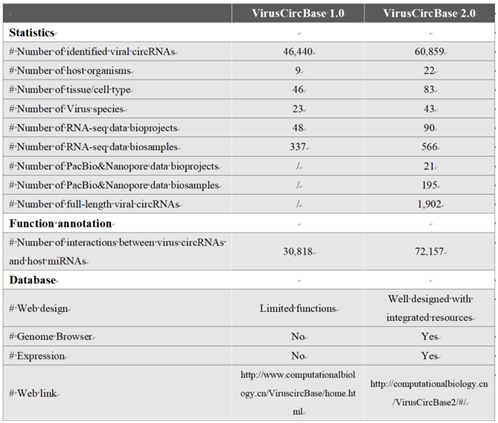
表1. VirusCircBase 1.0和VirusCircBase 2.0的比较
在数据库功能方面,VirusCircBase 2.0提供了三个新功能:i)以热图形式显示病毒circRNA在样本中的表达水平;ii)以基因组浏览器形式显示病毒circRNA在病毒基因组上的表达情况;iii)按宿主浏览病毒circRNA。
图1. VirusCircBase 2.0的首页截图
病毒circRNA的表达分析显示,它们在大多数细胞或组织中的表达水平较低,表现出较强的表达异质性(图2)。病毒circRNA的剪接分析显示,它们与动植物相比,使用了更高比例的非经典反向剪接信号,并主要使用了A5SS。大多数病毒circRNA没有超过两个异构体。最后,对与病毒circRNA产生相关的人类基因进行研究发现超过1000个人类基因与病毒circRNA的表达呈中等相关性。其中大多数显示出负相关性,包括42个编码RNA结合蛋白的基因。它们在与细胞周期和RNA加工相关的生物过程中显著富集。总的来说,该研究为进一步研究病毒circRNA提供了有价值的资源,也为病毒circRNA的生物合成机制提供了新的见解。
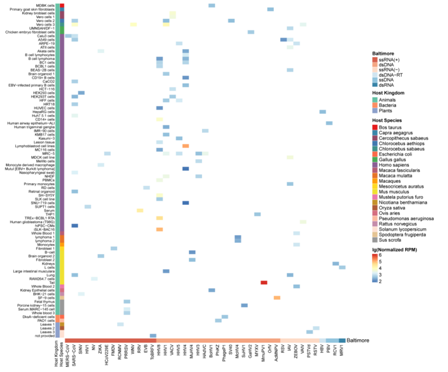
图2.病毒circRNA在不同宿主的不同组织或细胞中的表达
该工作已在新发感染病权威期刊Emerging Microbes & Infections(IF 2023=13.2)在线发表,题为“An updated database of virus circular RNAs provides new insights into the biogenesis mechanism of the molecule”,在更新版本的数据库VirusCircBase 2.0中,该研究成果不仅显著增加了数据库中的数据量和功能,为进一步研究病毒circRNA提供了有价值的资源,还为病毒circRNA的生成机制提供了新的见解。
该论文的第一作者为565net必赢官方网的博士研究生傅萍,通讯作者为565net必赢官方网生物信息中心、医学病毒学湖南省重点实验室的教授彭友松。这项工作得到了国家重点研发计划(2022YFC2303802)和国家自然科学基金(32170651 & 32370700)的支持。
论文链接:
https://doi.org/10.1080/22221751.2023.2261558
论文信息:
Fu P, Cai Z, Zhang Z, Meng X, Peng Y. An updated database of virus circular RNAs provides new insights into the biogenesis mechanism of the molecule. Emerg Microbes Infect. 2023 Sep 19:2261558. doi: 10.1080/22221751.2023.2261558. Epub ahead of print. PMID: 37725485.
