王柯敏/何晓晓团队和湖南省肿瘤医院等单位合作,报道了一种基于轨道自助型三维DNA步行器的肿瘤外泌体糖蛋白分析与超灵敏检测方法,相关研究成果以“A Self-Serviced-Track 3D DNA Walker for Ultrasensitive Detection of Tumor Exosomes by Glycoprotein Profiling”为题发表在国际化学领域权威期刊《德国应用化学》(Angewandte Chemie International Edition)上。565net必赢官方网博士研究生王绘珍是论文的第一作者。

外泌体(Exosomes, Exos)是由细胞释放的纳米级脂质囊泡(30-150 nm),其表面携带大量的糖脂和糖蛋白等生物活性分子。蛋白质的糖基化(Glycosylation),作为最重要的蛋白质翻译后修饰(Protein translational modifications,PTMs)方式之一,是一类参与多种生理和病理过程的重要生物分子。通过分析蛋白的糖基化水平可以更好地了解肿瘤外泌体在细胞间通讯中的信号传导特性。因此,检测外泌体的糖蛋白水平对于癌症的非侵入诊断具有重要意义。然而,在肿瘤的早期阶段,外泌体的表达含量很低,这为其灵敏、准确检测带来极大挑战。
三维DNA步行器,作为最突出的分子机器之一,因其高的比表面积和大的装载量而表现出强大的信号放大能力,在生物传感中展现出很强的应用潜力。目前研究者已开发了多种基于不同轨道载体的智能响应型DNA步行器,如基于金颗粒、磁珠等,以及后续发展的基于磷脂双分子层的三维轨道。其中以磷脂双分子层为轨道载体的三维DNA步行器的行走效率得到了很大提升,但用于外泌体检测仍存在一些关键问题亟待解决,如(Ⅰ)三维轨道制作过程复杂、合成产率低、成本高、耗时;(Ⅱ)大多数方法通常需要复杂的外泌体纯化步骤和较昂贵的精密仪器。
基于此,研究团队利用外泌体表面的磷脂双分子层作为三维行走轨道,以SMMC-7721肝癌细胞外泌体表面高度表达的N-糖蛋白(GalNAc)为靶标,采用特异性识别的N-糖蛋白裂开型核酸适配体作为分子识别探针,结合催化发夹自组装反应,开发了一种轨道自助型三维DNA步行器(STDW),通过分析N-糖蛋白表达水平实现肿瘤外泌体免洗、高灵敏检测研究(图1)。
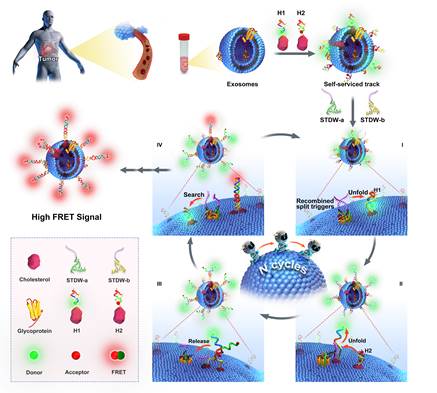
图1.基于核酸适配体特异性识别和催化发夹组装驱动的轨道自助型三维DNA步行器(STDW)的肿瘤外泌体免洗、高灵敏检测示意图.
该方法设计简便巧妙,利用靶标外泌体为轨道载体,避免传统DNA步行器需引入纳米载体并进行化学修饰等复杂步骤,极大地简化了操作过程。得益于裂开型触发链的低背景优势和催化发夹组装驱动的DNA步行器的信号放大效应,STDW能实现靶标外泌体的高灵敏检测,检测限为1 particle/μL。该方法可用于细胞培养基和临床血浆样本中靶标外泌体的直接检测,为早期癌症诊断和术后监控提供了新的思路。
论文链接:https://doi.org/10.1002/anie.202116932
